Composición atómica
Un átomo es la unidad básica de un elemento que puede
intervenir en una combinación química.
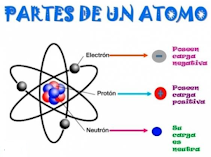
Están constituidos por partículas de menor tamaño, protones,
neutrones y electrones.
 Todos los átomos
tienen un núcleo, formado por protones y neutrones, alrededor del cual se
encuentran los electrones (zona extranuclear). El número de protones en el
núcleo coincide con el número de electrones en la nube, por lo tanto, los
átomos son eléctricamente neutros.
Todos los átomos
tienen un núcleo, formado por protones y neutrones, alrededor del cual se
encuentran los electrones (zona extranuclear). El número de protones en el
núcleo coincide con el número de electrones en la nube, por lo tanto, los
átomos son eléctricamente neutros.

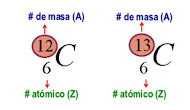
Son átomos que poseen el mismo número atómico (Z) pero
diferente número másico (A) Para la mayoría de los elementos, los núcleos de
sus átomos, pueden tener distinto número de neutrones.
Los átomos de un mismo elemento (igual valor de Z) con
distinto número de neutrones, se llaman isótopos.
Son átomos que han perdido o ganado electrones.
Si un átomo pierde electrones, queda con más carga positiva que negativa y se transforma en un CATIÓN (ión positivo). Si un átomo gana electrones queda con más carga negativa que positiva y se transforma en un ANIÓN (ión negativo)
Modelos atómicos
Históricamente existieron muchos modelos que intentaban
explicar cómo estaba “organizado” un átomo y sobre todo sus electones.
Finalmente, se llegó a una descripción bastante acertada que indica que los
electrones se encuentran distribuídos en NIVELES de energía ( cercanía al
núcleo) y dentro de cada NIVEL en SUBNIVELES.
La siguiente tabla te muestra cómo es la distribución
Para recordar en forma rápida la distribuión te dejo la regla de las diagonales.
Organiza los elementos en columnas y filas según sus
propiedades y su CE

PROPIEDADES BÁSICAS DE LOS GRUPOS DE ELEMENTOS
Los metales presentan brillo propio
característico, son maleables (se convierten en láminas), dúctiles (se convierten el hilos),
buenos conductores del calor y la electricidad, y en su mayoría sólidos a
temperatura ambiente.
Los no metales en cambio, resultan malos
conductores del calor y la electricidad, a temperatura ambiente pueden ser
sólidos, líquidos y gaseosos.
Los gases inertes, en tanto son gases a
temperatura ambiente y se caracterizan por su casi total inactividad química.
Hay ciertos elementos que no tienen propiedades bien
definidas, sino intermedias entre las de un metal y un no metal y se llaman metaloides,
están situados próximos a la línea escalonada que divide los metales de los no
metales (ejemplos Germanio y Antimonio)
Ciertos grupos de elementos tienen más facilidad para ganar o perder electrones, siempre de la misma manera. Te los dejo en la siguiente tabla.
PROPIEDADES
PERIÓDICAS
Son las propiedades de los átomos que dependen de la cantidad de
electrones en su órbita externa, o sea dependen de su período
Radio atómico: es la mitad de la distancia
entre los dos núcleos de dos átomos adyacentes. El radio aumenta a medida
que aumenta el número atómico, dentro de un grupo y disminuye a medida que
aumenta el número atómico en un período.
Radio Iónico:
·
En el caso en que se forme un catión, el radio
de éste es menor al de sus respectivos átomos.
·
los radios de los cationes aumentan al descender
en un grupo.
·
cuando se forma un anión, el radio es mayor que
el del
elemento en estado neutro.
Energía de Ionización: La energía de
ionización es la energía que se requiere para arrancar un electrón de un átomo en
estado gaseoso, en su estado fundamental. La primera energía de ionización
corresponde a la energía necesaria para quitar un electrón de un átomo y la
segunda energía de ionización corresponde a quitar un electrón del catión
resultante. Siempre se cumple que la primera energía de ionización es menor
que la segunda.
La primera energía de ionización aumenta a medida que
aumentan los números atómicos de los elementos dentro de un período y disminuye
a medida que aumenta el número atómico en un grupo.
Electronegatividad: Es la capacidad de un
átomo para atraer hacia su núcleo los electrones en un enlace. Aumenta al
aumentar Z en un mismo grupo y disminuye al aumentar Z en un grupo. Un
átomo con afinidad electrónica y energía de ionización altas posee electronegatividad
alta.
Algunos ejercicios explicados
Para Mg: Z=12 ( por lo tanto el átomo tiene 12 protones y
como es neutro debe tener 12 electrones) Luego A= Z+n, por lo tanto 24= 12 +n,
el átomo tiene 12 neutrones.
Luego para definir quienes son isótopos, tenés que fíjate
que Z sea igual y A sea distinto (es la definición de isótopo). Por lo tanto
las parejas de isótopos son 2412Mg
y 2512Mg ; 4019K y 3919K
a)FALSO. El número de protones es igual al de electrones
para que la carga neta sea nula.
b)VERDADERO, en su estado natural la carga de protones y
electrones está balanceada.
c)FALSO. Un ión es un átomo con carga neta, por lo tanto el
número de cargas positivas ( protones) y negativas(electrones) DEBE ser
diferente.
d)VERDADERO. La definición de isótopo dice que son átomos
del mismo elemento ( ósea mismo Z) y distinto número másico. Por lo tanto lo
diferente es el número de neutrones.
e)FALSO. El anión es un ión negativo, por lo tanto debe
tener más electrones que protones.









No hay comentarios.:
Publicar un comentario